液体が一瞬で凍る「過冷却」現象とは?

冬の寒さが少しずつゆるんでくる今日この頃。
1月の大寒のころは今年も雪になりましたね。気温が氷点下になり、道路が凍結してひやっとすることがありました。路面凍結や積雪のときは、ペンギン歩きするといいそうです。
「氷点下」に「凍結」。
氷に関する言葉が出たところで本題です。
冷凍庫でギリギリ凍らない程度に冷やした水やお茶に衝撃を加えると、端からぶわぁ~っと凍っていく現象を見たことはありますか??
これは「過冷却」という状態を利用した現象です。
今回はこの過冷却という現象についてくわしく見ていきましょう。
お茶やジュースのように何かが溶けていると少し話が変わってしまいますので、純粋な水を冷やすと仮定して考えていきますね。
1. 物質の三態をイメージすると?
物質にはさまざまな状態が存在します。
水であれば温度が低いほうから、固体の氷、液体の水、気体の水蒸気の三つがよく知られている状態です。
固体・液体・気体の三つを「物質の三態」と呼び、それぞれの状態を簡単にイメージすると次のようになります。
- 固体(氷)→粒子が規則正しく並んでいて、細かく震えている状態。
- 液体(水)→粒子が不規則に集まり、ゆっくりと動き回っている状態。
- 気体(水蒸気)→粒子が広範囲を、自由に高速で飛び回っている状態。
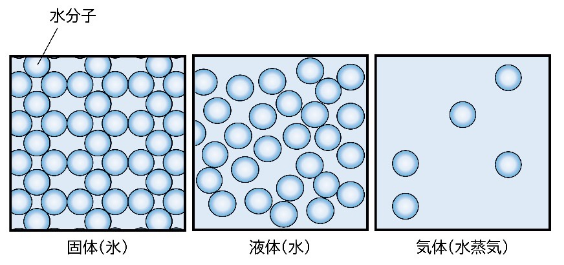
気体の状態の粒子は運動の様子が激しく、大きなエネルギーを持っている状態です。
一方、固体の状態の粒子は運動が穏やかで、小さなエネルギーしか持っていない状態だと言えます。
この「粒子の持つエネルギー」がその物質の温度を表していて、
持っているエネルギーが大きい⇔温度が高い
持っているエネルギーが小さい⇔温度が低い
と対応しているわけです。
2. 液体が固体に変化するときに起きていること
液体を冷やしていくというのは粒子からエネルギーを奪うということです。
エネルギーが奪われた粒子たちは徐々に動きが遅くなっていきますから、気体から液体へ、液体から固体へと変化していきます。
例えば水蒸気を冷やしたときは、空間を飛び回っていた粒子がエネルギーを奪われて、ある一定の速度よりも遅くなり、その粒子は液体に変化することができるようになります。
「変化する」ではなく「変化することができる」という表現が大事なんです。
エネルギーが減って動きが遅くなった粒子は、空気中に存在するちりなどを核にして集まることで液体(水滴)となって現れます。
グラフの100℃で温度が変化しない区間があるのは、温度を下げるためではなく「集まって液体に変化する」ためにエネルギーの変化が利用されるからです。
この瞬間はちょっと大きめのエネルギー変化が必要になります。
つまり、ゆっくりと冷やし(ゆっくりとエネルギーを減少させ)、同時に核となる物質が存在しない場合は、「液体になることができる粒子」でも気体のまま存在することがあります。
そして、これと同じような現象が、水を冷やして0℃になったときにも発生します。
水を冷やしてエネルギーを減少させると、その粒子は固体(氷)に変化できる状態になります。
この粒子の近くに核となるものが存在すれば、その核を中心として氷へと変化します。
ちなみに、この核には「種結晶」という名前がついています。
この集まって氷になる瞬間も、ちょっと大きめのエネルギー変化が必要になります。
この「固体に変化できる」温度が0℃というわけですが、ゆっくりと冷却しつつ、かつ核となるものが存在しなかったとしたら…。
そうです。
気体から液体のときと同様、エネルギー(温度)は低いけれど固体にはなれない粒子が存在する状態になるのです。
すなわち、「-3℃の水」のような状態ができ上がります。
これが過冷却状態の水というわけです。
3. 過冷却水に衝撃を加えてみたら?
さて、不純物の少ない水をゆっくりと冷却して0℃よりも低い温度(例えば-3℃)の水を作ったとしましょう。
ここに衝撃を加えると最初の動画のように端から順に凍っていくわけですが、これは「集まって固体になる」ために必要なエネルギーを「外部からの衝撃」という形で外供給しているということになります。
水が蓋に激しくぶつかることで、固体になれる状態の粒子たちが不純物を核として種結晶を形成します。
そして、一部が固体になってしまえばその周りから順に氷へと変化していき、最終的には容器内のすべての粒子が氷へと変化します。
このとき、動き回っていた粒子が一気にその場に止まって震えるだけになる、つまり粒子が持っていたエネルギーが放出されるため、氷全体の温度は0℃近くにまで上昇してしまいます。
4. 過冷却実験をするときの注意点
過冷却実験は用意するものも少なく、夏休みの自由研究などの題材としても比較的扱いやすい実験だと思います。
しかし、実際に実験を行う際に気をつけるべき点がいくつかあるので確認してみましょう。
まず一つ目は「不純物の少ない水を使用する」ということです。
水が氷に変化するためには、核となるものが必要でした。
核は水の中に存在する不純物であることが多いので、その核となるものをできる限り減らした状態で実験をすることでより低い温度まで冷やすことができ、過冷却実験を成功させやすいといえるでしょう。
水を入れる容器は念入りに洗ってきれいにしておくことが大事です。
さらに、水道水やミネラルウォーターを用いるよりも、水道水を一度煮沸して作った純水(精製水)を用いて実験をするのがよいですね。
※超純水(50mプールに耳かきひとさじ程度の不純物しか含まれていないほど純度の高い水)を用いると-15℃まで過冷却状態を維持できるようですが、超純水は500mLで5000円もする高級品ですので、一般の方にはおすすめできません。
二つ目の条件として「ゆっくりと冷却する」ということです。
ペットボトルなどの容器に入れた水は、外から冷やすことになります。
これを急速に冷却した場合、外側のほうが中心よりも温度が低い状態になります。
一塊の液体のなかで温度の差があると水の対流が発生します。
急激に冷やして水の内側と外側の温度差を大きくしてしまうとその対流が激しくなってしまいます。
粒子と粒子、粒子と容器の壁面がぶつかり、摩擦などが発生した結果、種結晶というものができてしまい、過冷却状態にならずに凍ってしまうことがあるようです。
そのため、過冷却水を作るためには「ゆっくりと」、つまり水の中心部分と外側の温度の差ができないように冷やすことが重要になるわけです。
以上の点に気をつけて、みなさんもぜひ過冷却実験をしてみてくださいね。
5. 水以外の過冷却状態って発生するの?
察しのいい方はお気づきでしょう。
水以外にも過冷却という状態は発生しうるのです。
では、一例として、凝固点の高い酢酸ナトリウムという物質を紹介しますね。
酢酸ナトリウムは凝固点が58℃と高めの温度ですが、一度加熱したあと58℃以下まで冷えても種結晶が作られづらいという性質があります。
水よりも実験に成功しやすいということですね。
58℃を下回った液体の酢酸ナトリウムに、酢酸ナトリウムの結晶を種結晶として直接放り込んであげることでそこから結晶が広がっていく様子を観察することができます。
これは商品として実験セットが販売されており、気軽に入手できます。
気になる方、ぜひチェックしてみてはいかがですか。
